
Nitrür Formülü Nelerdir?
Nitrürler, azot atomları içeren bileşikler olarak önemli bir kimyasal grubu temsil eder. Yüksek sıcaklık dayanımı ve sertlik gibi özellikleriyle endüstriyel uygulamalarda geniş bir yelpazede kullanılır. Nitrürlerin kimyasal formülleri, bileşenlerin oranlarını belirleyerek fiziksel ve kimyasal özelliklerini anlamaya yardımcı olur.
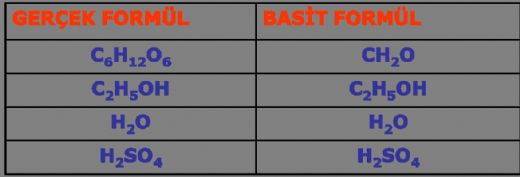
Nitrür Formülü Nedir?Nitrür, azot atomlarının bir bileşikte bulunmasını ifade eden bir terimdir. Genellikle metal ve azot kombinasyonlarından oluşan bileşiklerdir. Nitrürler, özellikle yüksek sıcaklık dayanımı ve sertliği ile bilinirler. Bu özellikleri nedeniyle, çeşitli endüstriyel ve mühendislik uygulamalarında sıklıkla kullanılmaktadırlar. Nitrür formülünün belirlenmesi, bileşiğin kimyasal yapısını ve özelliklerini anlamak açısından büyük önem taşımaktadır. Nitrürlerin Kimyasal Formülü Nitrürlerin kimyasal formülleri genellikle bileşenlerin atom sayısına dayanmaktadır. En yaygın nitrür formüllerinden bazıları şunlardır:
Bu formüller, bileşikteki elementlerin oranlarını gösterir ve nitrürlerin fiziksel ve kimyasal özelliklerinin belirlenmesine yardımcı olur. Nitrürlerin Özellikleri Nitrürler, birçok önemli fiziksel ve kimyasal özelliğe sahiptir. Bu özellikler, nitrürlerin endüstriyel uygulamalarındaki önemini artırmaktadır. Nitrürlerin başlıca özellikleri şunlardır:
Bu özellikler, nitrürleri özellikle seramik, elektronik ve otomotiv endüstrileri gibi alanlarda kullanılabilir hale getirmektedir. Nitrürlerin Kullanım Alanları Nitrürler, çeşitli endüstriyel ve teknolojik uygulamalarda kullanılmaktadır. Bunların başlıca kullanım alanları şunlardır:
Bu kullanım alanları, nitrürlerin endüstriyel üretim ve mühendislik süreçlerindeki önemini vurgulamaktadır. Sonuç Nitrürler, azot atomlarının bileşen olarak bulunduğu önemli kimyasal bileşiklerdir. Yüksek sıcaklık dayanımı, sertlik ve kimyasal dayanıklılık gibi özellikleri sayesinde çeşitli endüstriyel uygulamalarda kullanılmaktadırlar. Nitrür formüllerinin doğru belirlenmesi, bu bileşiklerin kimyasal yapısını ve potansiyel kullanım alanlarını anlamada kritik bir rol oynamaktadır. Nitrürlerin gelecekteki araştırma ve geliştirme süreçlerinde daha fazla yer alması beklenmektedir. Ekstra Bilgiler Nitrürlerin araştırılması, özellikle yeni nesil elektronik cihazların geliştirilmesinde önemli bir rol oynamaktadır. Özellikle, galliyum nitrür (GaN) teknolojisi, yüksek verimli enerji dönüştürücüler ve LED aydınlatma uygulamalarında devrim yaratmıştır. Gelecekte, nitrürlerin daha fazla özellik ve uygulama için potansiyeli keşfedilmeye devam edilecektir. |
















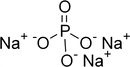









Amonyum nitrür, amonyum (NH4)+ ve nitrür (N3-) bileşikleri bir araya gelerek (NH4)3N bileşiğini oluşturur demişsiniz. Bu bileşiğin nasıl bir yapıya sahip olduğunu daha detaylı açıklar mısınız?
Merhaba Veda,
Amonyum Nitrürün Yapısı: Evet, (NH4)3N bileşiği, amonyum iyonları (NH4)+ ve bir nitrür iyonu (N3-) içerir. Bu bileşik, üç amonyum iyonunun bir nitrür iyonu ile birleşmesiyle oluşur.
Yapısal Özellikler: Amonyum iyonu, merkezde bir azot atomu ve bu azota bağlı dört hidrojen atomundan oluşur. Nitrür iyonu ise tek bir azot atomudur. Amonyum iyonları pozitif yüklü olduğu için, negatif yüklü nitrür iyonu ile elektrostatik çekim kuvvetleri ile bir arada tutulurlar.
Kimyasal Bağlar: Bu bileşikteki bağlar iyonik bağlar olarak sınıflandırılır, çünkü amonyum iyonları ve nitrür iyonu arasında elektron transferi gerçekleşir ve bu da iyonik bir bileşiğin oluşumuna yol açar.
Uygulamalar ve Kullanım: Amonyum nitrür, genellikle laboratuvar ortamında incelenir ve bazı özel kimyasal reaksiyonlarda kullanılabilir. Ancak, doğada yaygın olarak bulunmaz ve genellikle kararlı bir bileşik değildir.
Umarım bu açıklama yardımcı olmuştur. Başka sorularınız olursa lütfen sormaktan çekinmeyin.