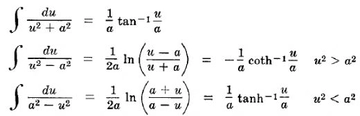Elektrokimya formülleri nelerdir ve nasıl kullanılır?
Elektrokimyanın temel prensipleri ve bu alanda kullanılan formüller, kimyasal reaksiyonlarla elektrik enerjisi arasındaki ilişkiyi anlamamızı sağlar. Nernst denkleminden Faraday yasalarına kadar bu matematiksel araçlar, pil teknolojilerinden elektroliz süreçlerine kadar geniş bir uygulama yelpazesinde hayati öneme sahiptir.
Elektrokimya Nedir?Elektrokimya, kimya ve elektrik arasındaki etkileşimi inceleyen bir bilim dalıdır. Bu alan, elektrik akımının kimyasal reaksiyonları nasıl etkilediğini ve kimyasal reaksiyonların elektrik akımını nasıl oluşturduğunu araştırır. Elektrokimyasal hücreler, elektroliz, pil ve batarya teknolojileri gibi birçok uygulama alanına sahiptir. Elektrokimyasal süreçlerin anlaşılması, enerji üretimi, kimyasal sentez, koruma mühendisliği ve çevre teknolojileri gibi birçok alanda büyük öneme sahiptir. Elektrokimya Formülleri Elektrokimya, çeşitli formüller ve denklemler kullanarak kimyasal reaksiyonları ve elektriksel olayları tanımlar. Bu formüller arasında en yaygın olanları şunlardır:
Nernst Denklemi Nernst denklemi, bir elektrokimyasal hücrenin voltajını belirlemek için kullanılır. Denklemin formülü aşağıdaki gibidir: E = E° - (RT/nF) lnQBu denklemin elemanları şunlardır: E: Hücrenin potansiyeli (volt cinsinden) E°: Standart potansiyel (volt cinsinden) R: Gaz sabiti (8.314 J/(mol·K)) T: Sıcaklık (Kelvin cinsinden) n: Elektron transferi sayısı F: Faraday sabiti (96485 C/mol) Q: Reaksiyonun durumu (ürünlerin ve reaktantların konsantrasyonlarıyla hesaplanır) Bu denklem, bir hücredeki potansiyelin nasıl değiştiğini anlamaya yardımcı olur ve elektrokimyasal süreçlerin optimizasyonu için kritik öneme sahiptir. Gibbs Serbest Enerji Denklemi Gibbs serbest enerjisi, bir sistemin termodinamik potansiyelini belirler ve elektrokimyasal süreçler için oldukça önemlidir. Formülü şöyledir:ΔG = -nFEBurada: ΔG: Gibbs serbest enerjisi değişimi (J/mol) n: Elektron transferi sayısı F: Faraday sabiti E: Elektrokimyasal potansiyelBu denklem, bir elektrokimyasal tepkimenin gerçekleşip gerçekleşmeyeceğini belirlemeye yardımcı olur. Pozitif ΔG değerleri, tepkimenin gerçekleşmeyeceğini, negatif ΔG değerleri ise tepkimenin gerçekleşeceğini gösterir. Faraday Yasası Faraday yasası, elektrik akımının, kimyasal değişim miktarını nasıl etkilediğini ifade eder. İlk Faraday yasası, bir kimyasal reaksiyonun gerçekleşmesi için gerekli elektrik miktarını belirler: m = (Q/96485) MBurada: m: Kimyasal ürün veya reaktan kütlesi (gram cinsinden) Q: Geçen elektrik yükü (coulomb cinsinden) M: Kimyasal maddenin molar kütlesi (g/mol) Bu yasa, elektroliz süreçlerinde yaygın olarak kullanılmaktadır ve belirli bir süre boyunca uygulanan elektrik akımı ile ne kadar madde oluşacağını veya tükeneceğini hesaplamada kullanılır. Ohm Yasası Ohm yasası, elektrik akımının direnç ve voltaj ile olan ilişkisidir ve elektrokimyasal hücrelerde de uygulanabilir: V = IRBurada: V: Voltaj (volt cinsinden) I: Akım (ampere cinsinden) R: Direnç (ohm cinsinden) Bu yasa, elektrokimyasal hücrelerin performansını değerlendirmek ve optimize etmek için önemlidir. Uygulama Alanları Elektrokimya formülleri, geniş bir yelpazede uygulama alanlarına sahiptir:
Bu alanlardaki uygulamalar, ekonomik ve çevresel sürdürülebilirlik üzerinde önemli etkilere sahiptir. Sonuç Elektrokimya formülleri, kimyasal ve elektriksel süreçlerin anlaşılması için kritik bir rol oynamaktadır. Nernst, Gibbs, Faraday ve Ohm yasaları, elektrokimyasal reaksiyonların kinetiğini incelemek ve optimize etmek için kullanılmaktadır. Bu formüllerin doğru bir şekilde uygulanması, enerji üretimi, çevre teknolojileri ve askeri uygulamalar gibi birçok alanda önemli avantajlar sağlar. Elektrokimya, gelecekte daha fazla yenilik ve gelişme potansiyeline sahiptir. |